Блок 1. Коротко
— Лікування гіпонатріємії базується на етіологічному діагнозі гіпонатріємії, і відповідну оцінку необхідно повторювати на кожному етапі обстеження пацієнта з визначенням фактичного рівня натрію (Na), тяжкості гіпонатріємії, класифікацією об’єму, вимірюванням тонусу. Важливе й виявлення факторів, що сприяють виникненню і обтяжують перебіг хвороби.
— Тяжка або глибока гіпонатріємія потребує негайного лікування 3% гіпертонічним розчином у вигляді болюсної терапії або тривалої інфузії. Тривалість і обсяг лікування залежать від підвищення бажаного рівня натрію в сироватці крові (sNa) і полегшення симптомів.
— Хронічна гіпонатріємія зазвичай має менш тяжкі симптоми, класифіковані як легкі або помірні відповідно до рівня Na, а лікування базується на об’ємі рідини. При гіповолемічній гіпонатріємії об’єм компенсують або внутрішньовенним введенням фізіологічного розчину, або пероральним прийомом Na і води.
— Гіперволемічна гіпонатріємія, спричинена декомпенсованим захворюванням серця або печінки та нефротичним синдромом, збільшує позаклітинний, але зменшує внутрішньосудинний об’єм, що стимулює невідповідну секрецію антидіуретичного гормону (АДГ). Отже, обмеження рідини (ОР) є першою лінією лікування, за винятком пацієнтів із прогресуючими захворюваннями печінки або серця. Другим варіантом є застосування петльових діуретиків. Тут антагоніст рецепторів V2 толваптан є визнаним препаратом вибору, майже без ризику надмірної корекції, якщо не застосовувати його одночасно з петльовими діуретиками. Застосування альбуміну було виправданим у пацієнтів із прогресуючими захворюваннями печінки. Нарешті, пацієнтів із серцевою недостатністю та гіперволемічною гіпонатріємією можна успішно лікувати пероральним прийомом сечовини. Останнім засобом лікування є інгібітори натрій-глюкозного котранспортера 2 (SGLT2).
— Найпоширенішою причиною еуволемічної гіпонатріємії легкого та помірного ступеня є синдром неадекватного антидіуретичного гормону (SIADH). Лікування спочатку має бути причинно-наслідковим, оскільки воно відрізняється у випадку діагностованого SIADH. Відповідно до європейських і американських рекомендацій, ОР є варіантом лікування першої лінії, хоча його ефективність невисока. Утім, порада «пийте, коли відчуваєте спрагу або їсте» може бути корисною. Перед початком ОР слід враховувати збережену функцію нирок зі здатністю виводити вільну воду. Петльові діуретики є лікуванням другої лінії, хоча доказів бракує. Ваптани вважаються доказовими препаратами вибору. Що ж до добавки сечовини, то немає доказів її ефективності та безпеки. Інгібітори SGLT2 можна розглядати як ефективне лікування порівняно з плацебо.
Вступ
Гіпонатріємія виникає внаслідок первинного дисбалансу споживання та втрати води без електролітів, рідше — через зміни вмісту солі в організмі. Це найчастіша електролітна аномалія, яка визначається як концентрація сироваткового натрію (sNa) < 135 ммоль/л [1]. Диспропорція між загальною кількістю води в організмі та вмістом Na < 120 ммоль/л вважається тяжкою гіпонатріємією [2].
Епідеміологія
Найвища поширеність може бути виявлена серед госпіталізованих пацієнтів у відділеннях інтенсивної терапії похилого віку (20–35 %), із підвищеним ризиком смертності через численні супутні захворювання та ліки [3]. Гіпонатріємія також була зареєстрована у 50 % пацієнтів із субарахноїдальним крововиливом у нейрохірургічних відділеннях [4] та 20 % пацієнтів із серцевою недостатністю [5]. Крім того, невідповідна практика призначення й обмежені знання багатьох лікарів демонструють необхідність втручання для мінімізації ризиків госпітальної гіпонатріємії [6]. Існує мало доступних даних щодо гіпонатріємії та рекомендацій із клінічної практики, які б підтримували відповідні рішення щодо діагностики та лікування для стандартизації догляду за пацієнтами [7]. Також наявні керівні документи відрізняються методологічною точністю, а рекомендації не завжди є послідовними [8]. До того ж, певно, наявні на даний момент європейські [9] й американські рекомендації [10] недостатньо враховують цілісні та індивідуальні аспекти кожного пацієнта, з регулярним спостереженням і варіаціями у вимірюванні sNa, а не окремих значень Na в сироватці або сечі [11].
У цій статті розглядаються поточні стандарти лікування гіпонатріємії, головним чином зосереджені на лікуванні гіпотонічної або справжньої гіпонатріємії, а також нові розробки, засновані на патофізіології через наявні вказівки щодо діагностики, оптимізованого лікування та профілактики ускладнень надмірної корекції.
Стандарти лікування
Гіпонатріємія — складний стан, пов’язаний із різноманітними симптомами та викликаний різними етіологічними факторами, що вимагає мультидисциплінарного діагностичного підходу. Однак перед початком лікування слід визначити кілька параметрів.
Види гіпонатріємії
Гіпонатріємія, що розвивається протягом < 48 годин, називається гострою, зазвичай виявляється у післяопераційних пацієнтів із надмірним введенням рідини або самоіндукованою водною інтоксикацією та тяжкими симптомами. Якщо тривалість гіпонатріємії невідома або становить ≥ 48 год, її називають хронічною, вона зазвичай перебігає безсимптомно або з легкими симптомами.
Ступінь гіпонатріємії може бути тяжким (sNa < 120 ммоль/л), помірним (sNa 120–129 ммоль/л) або легким (sNa 130–134 ммоль/л).
Тяжкість симптомів може бути великою (судоми, кома, зупинка дихання), від легкої до помірної — неспецифічної (головний біль, млявість, втома, запаморочення, нудота, блювання, сплутаність свідомості, забудькуватість, порушення ходи, м’язові судоми) або безсимптомної.
Госпіталізація часто необхідна пацієнтам із гострою, тяжкою та симптоматичною гіпонатріємією, які мають ризик розвитку ускладнень від гіпонатріємії, що не лікувалася або піддавалася агресивному лікуванню (надлишковій корекції). Це дозволяє часто контролювати й оцінювати концентрацію sNa, виділення сечі та неврологічний стан.
Тонічність при гіпонатріємії іноді необхідна для оцінки вільного руху води та визначення гіпотонічної (знижена концентрація розчиненої речовини < 275 мОсм/кг), ізотонічної (275–290 мОсм/кг) або гіпертонічної гіпонатріємії (> 290 мОсм/кг) з помилково низьким sNa [12, 13]. Таку псевдогіпонатріємію можна виявити за наявності гіперглікемії та/або гіпертригліцеридемії, які підвищують тонус сироватки крові та виводять воду з клітин. Відповідно, позаклітинний водний простір розширюється, і, таким чином, рівні sNa знижуються. Швидка корекція гіперглікемії без відповідного збільшення sNa може знизити осмоляльність сироватки крові та викликати набряк мозку, особливо у молодих людей з кетоацидозом [14]. Псевдогіпонатріємія, що спостерігається при наявності гіпертригліцеридемії, може бути виявлена у пацієнтів з панкреатитом і діабетичним кетоацидозом [15].
Об’єм позаклітинної рідини (ECF) може додатково розділити гіпонатріємію на гіповолемію, еуволемію або гіперволемію [16]. Визначити об’ємний статус пацієнта часто важко, але це може бути дуже корисним для визначення етіології втрат рідини та зменшення об’єму ECF, погіршення тканинної перфузії та відсутності нормальної реакції на вивільнення та/або пригнічення секреції АДГ. Неадекватно пригнічений АДГ може бути виявлений у пацієнтів з гіповолемією та пацієнтів із серцевою недостатністю або цирозом печінки, які також можуть бути набряковими (гіперволемічна гіпонатріємія). В обох випадках спостерігається зниження ефективного об’єму артеріальної крові, порушення екскреції Na та низька концентрація Na у сечі, тобто осмоляльність. Тут найпоширенішим лікуванням гіпонатріємії є 3% гіпертонічний розчин. Його слід постійно контролювати у поєднанні з одночасним внутрішньовенним (IV) введенням фуросеміду (10–20 мг один раз на день), щоб сприяти виведенню води за допомогою форсованого натрійурезу. Крім того, якщо причиною гострої гіпонатріємії є парентеральне введення рідини пацієнтам із післяопераційним синдромом неадекватного антидіуретичного гормону (SIADH), великі об’єми ізотонічного фізіологічного розчину розширять ECF і погіршать набряк мозку. За наявності високих рівнів АДГ подальше зниження sNa через його виділення з концентрованою сечею посилить гіпонатріємію — явище, що відоме як «опріснення» [17]. Отже, введення ізотонічного фізіологічного розчину або розчину глюкози з додаванням 10 або 20 мекв хлориду натрію (NaCl) не рекомендується як неефективне та навряд чи пов’язане з розладом перевантаження водою, а не повним виснаженням Na в організмі.
Швидкість корекції загалом залежить від тяжкості симптомів [13]. Тип рідини та швидкість введення, як наріжний камінь початкового лікування, розраховуються на основі рівняння для дефіциту Na: (140 – sNa) × загальна вода в організмі, де загальна вода в організмі = маса тіла (у кг) × 0,6 [13, 18]. У пацієнтів з гострою або тяжкою гіпонатріємією з симптомами мета корекції sNa становить 4–6 ммоль/л протягом перших 6 годин або менше, і її слід підтримувати на такому ж рівні протягом перших 24 годин, щоб уникнути розвитку осмотичного синдрому демієлінізації. Швидкість корекції sNa не повинна перевищувати 8 ммоль/л протягом будь-якого наступного 24-годинного періоду [19]. Основним обґрунтуванням такого лікування є те, що збільшення sNa на 4–6 ммоль/л усуває більшість симптомів гіпонатріємії, а більші підвищення не дають жодних терапевтичних переваг [19 , 20]. І навпаки, ODS найчастіше виникав у пацієнтів, у яких рівень sNa був підвищений на > 10 ммоль/л протягом перших 24 годин або > 18 ммоль/л протягом 48 годин [21].
Важливо проводити щогодинний моніторинг при лікуванні гострої тяжкої гіпонатріємії з початковими болюсними введеннями щонайменше 100 мл 3% фізіологічного розчину, які можна повторювати після кожної біохімічної оцінки sNa до досягнення терапевтичної мети підвищення 4–6 ммоль/л. Частоту моніторингу можна зменшити до 6–12 годин після досягнення бажаного підвищення sNa.
Нарешті, незважаючи на всі профілактичні заходи для уникнення надмірної корекції гіпонатріємії, ODS може виникнути у пацієнтів із тяжкою гіпонатріємією, яка триває > 2–3 днів, з можливим виникненням водного діурезу. Ці пацієнти потребують стратегії порятунку для повторного зниження sNa з пероральним прийомом води, введенням 5% розчину глюкози (2–4 мл/кг/год) протягом 4 годин та/або десмопресину (1–3 мкг внутрішньовенно або підшкірно) з інтервалами 8–12 годин одночасно, з подальшим моніторингом sNa [9]. Терапію можна повторити, якщо рівень sNa не знижується ≈ 1 ммоль/л/год або поки він не досягне терапевтичної мети [10]. Більше того, коригувальні заходи щодо гіпонатріємії слід припинити після початку застосування стратегії зниження.
Резюме стратегій персоналізації лікування гіпонатріємії наведено у блоці 2.
Блок 2. Стратегії персоналізації лікування гіпонатріємії
— Належний діагноз гіпонатріємії є важливим для лікування. Як правило, тяжку гіпонатріємію, тобто глибоку та гостро розвинену гіпонатріємію (sNa < 125) із симптомами слід негайно лікувати. Після цього слід розглянути вимірювання тонусу й оцінку стану об’єму для подальшої причинної терапії та прогнозу.
— Тяжку гіпонатріємію терміново лікують повторними болюсними введеннями 100–150 мл або 2–4 мл/кг внутрішньовенно 3% HSS протягом 20–40 хвилин до досягнення бажаного підвищення sNa. Крім того, можна проводити безперервну інфузію в дозах 0,5–1 мл/кг/год. Порівняння двох підходів все ще обговорюється.
— Гіповолемічна гіпонатріємія легкого та помірного ступеня потребує адекватного заміщення об’єму внутрішньовенно фізіологічним розчином (NaCl 0,9%) 23–30 мл/кг/добу або, якщо можливо, пероральним прийомом 9 г Na (кількість, що еквівалентна 1 л NaCl 0,9%) з їжі та рідини.
— При гіперволемічній гіпонатріємії ОР є першою лінією лікування, якщо вона не спричинена передозуванням діуретиків (головним чином тіазидів) або шлунково-кишковою кровотечею, при якій також слід розглянути можливість заміни рідини. Зрозуміло, споживання рідини та діурез потребують ретельного контролю. Другим вибором є використання петльових діуретиків, які послаблюють реабсорбцію води, опосередковану АДГ, у дозах 20–40 мг кожні 8–12 годин. Рекомендоване споживання солі, що підсилює їхню дію, становить 3–5 г NaCl/добу. Толваптан є препаратом вибору при гіперволемічній гіпонатріємії, особливо у пацієнтів із серцевою недостатністю. Початкова доза становить 15 мг, що призводить до повільного збільшення sNa без ризику надмірної корекції та необхідності моніторингу рівня Na, якщо не застосовувати його одночасно з петльовими діуретиками. Застосування толваптану при рефрактерній гіпонатріємії схвалено. Застосування альбуміну у пацієнтів із прогресуючим захворюванням печінки виправдано як допоміжна терапія, яка підвищує онкотичний тиск і внутрішньосудинний об’єм, що зменшує стимуляцію АДГ. Лікування сечовиною є доцільним у пацієнтів із серцевою недостатністю в дозах 15–60 г/добу, оскільки вона сприяє вільній екскреції води, найімовірніше, через її осмотичний вплив на проксимальний каналець. Інгібітори SGLT2 можуть бути корисні як останній варіант лікування у пацієнтів із ХСН, хоча досі без переконливих доказів.
— У разі еуволемічної гіпонатріємії від легкого до помірного ступеня етіологічні причини слід виключити перед початком лікування SIADH. Незважаючи на те, що основними настановами ОР рекомендовано як терапію першої лінії, його ефективність видається сумнівною. З іншого боку, порада пити лише під час спраги або їжі може бути ефективною. Проте спостерігається дуже повільна корекція гіпонатріємії ОР зі швидкістю 1–2 ммоль/л кожні 24–48 год, але лише протягом кількох днів. Крім того, необхідною умовою для початку ОР є збережена функція нирок зі здатністю виводити вільну воду, яка зазвичай знижена у літніх людей. Петльові діуретики розглядаються як засіб другого вибору для лікування еуволемії, хоча рандомізованих досліджень бракує. Ваптани, безумовно, є ефективними препаратами з найкращими сучасними доказами нормалізації рівня Na майже за 48 годин. Початкова доза становить 7,5 мг, необхідний моніторинг параметрів крові та сечі для можливого запобігання надмірній корекції, якщо Na підвищується > 5 ммоль/л за 6 год. Якщо корекція sNa становить ≤ 8 ммоль/л через 24 години, дозу подвоюють до 15 мг за тією ж процедурою через 48 годин. При гіперкорекції при підвищенні до 5 ммоль/л підшкірно ввести 2 мкг десмопресину, а при до 6–8 ммоль/л — в/в 5% глюкозу з розрахунку 2–3 мл/кг/л. Немає доказів ефективності та безпеки сечовини як єдиного або комбінованого лікування з ваптанами. Початкова доза становить 15 г, і дозу можна не приймати, якщо є надмірна корекція Na, або подвоїти у разі недостатньої корекції Na на третій день. Інгібітор SGLT2 є ефективним засобом лікування в дозі 25 мг/добу, особливо у пацієнтів, які дотримуються дієти, багатої на натрій і калій.
При гострій гіпонатріємії з тяжкими симптомами (рис. 1) швидку корекцію за допомогою внутрішньовенного болюсу 100–150 мл або внутрішньовенного введення 2–4 мл/кг 3% гіпертонічного розчину солі (HSS) протягом 20–40 хв [22] повторювати залежно від стійкості симптомів [9] або давати до підвищення Na на 5 ммоль/л протягом 1–4 год [13]. Однак існує більша ймовірність надмірної корекції за допомогою болюсного HSS, тоді як недостатня корекція може бути недооцінена. Дійсно, у великому ретроспективному когортному дослідженні було доведено, що болюсне HSS незалежно пов’язане з більш частою надмірною та недостатньою корекцією у пацієнтів з масою тіла ≤ 60 кг та ≥ 100 кг [23]. Обсерваційне дослідження 62 пацієнтів у відділенні інтенсивної терапії підтвердило, що болюсна терапія HSS здатна коригувати Na стабільніше порівняно зі звичайним лікуванням ізотонічним фізіологічним розчином, але рівень надмірної корекції був значно вищий. З іншого боку, існує підвищений ризик недостатнього збільшення Na при звичайній терапії та набагато більшому діапазоні коливань Na. Отже, перевизначення стратегії болюсу шляхом зменшення об’єму болюсів та/або переоцінки часу для повторення може зменшити ризик надмірної корекції [24]. Утім, необхідна подальша перевірка у проспективних дослідженнях для безпечної й ефективної індивідуалізації болюсних доз.
/9.jpg)
Тяжку гіпонатріємію необхідно терміново лікувати без огляду на тип або етіологію, але одночасні заходи для корекції Na у перші 24 години слід опустити, оскільки швидка корекція гіпонатріємії також може призвести до ускладнень [25]. Петльові діуретики можна призначати пацієнтам із застійною серцевою недостатністю, гідрокортизон — у разі надниркової недостатності та хлорид калію — у разі гіпокаліємії. Як альтернативу можна проводити безперервну інфузію 3% HSS у дозах 0,5–1 мл/кг/год. Порівняння двох підходів все ще обговорюється.
Одне з небагатьох нещодавніх досліджень тяжкої гіпонатріємії, спричиненої SIADH, проспективно вивчало 50 пацієнтів, які отримували гіпертонічний фізіологічний розчин, який вводили або у вигляді повільної безперервної інфузії (SCI) зі швидкістю 20 мл/год, або у вигляді швидкого переривчастого болюсу (RIB) до двох 100-мл болюсів 3% HSS [26]. Первинним результатом була надмірна корекція в будь-який заданий період, що визначається як підвищення рівня sNa > 12 або 18 ммоль/л протягом 24 або 48 годин відповідно. Результати показали, що терапія RIB і SCI з використанням гіпертонічного розчину для лікування гіпонатріємії була ефективною та безпечною, незалежно від необхідності надмірної корекції. Однак RIB мала меншу частоту терапевтичного повторного зниження рівня і, як правило, мала кращу ефективність у досягненні бажаного рівня sNa протягом першої години порівняно з SCI. Загалом результати показали, що швидке періодичне введення гіпертонічного сольового розчину є кращим методом лікування симптоматичної гіпонатріємії, що відповідає поточним консенсусним рекомендаціям. Тому рекомендується використовувати 3% болюс HSS у дозах 100–150 мл (2–4 мл/кг) протягом 20–40 хвилин з повтореннями до досягнення бажаного рівня Na або як стратегію безперервної інфузії в дозах 0,5–1 мл/кг/год. Важливо, що пацієнтам з гіпокаліємією слід віддавати перевагу безперервній інфузії, надаючи можливість введення калію хлориду 20 ммоль/500 мл 3% HSS. У цьому комбінованому лікуванні гіпонатріємії та гіпокаліємії необхідний кон–троль рівня Na кожні 2 години, оскільки додавання калію призводить до додаткового витоку натрію з клітин і можливої швидкої надмірної корекції, тобто перевищення, з подальшою гіпернатріємією та ризиком розвитку ОРВ [27]. Важливо, що збільшення виділення сечі (водяний діурез) також може бути пов’язане з більшим підвищенням Na і, отже, потенційною надмірною корекцією.
Залишається відкритим питання, чи лікувати тяжку хронічну гіпонатріємію < 120 мекв/л. Хоча досі немає рандомізованого контрольованого дослідження (РКД) щодо такого лікування, повільне внутрішньовенне введення 3% HSS (15–30 мл/год), навіть безсимптомним пацієнтам із регулярним спостереженням для запобігання СОР було б корисним [28].
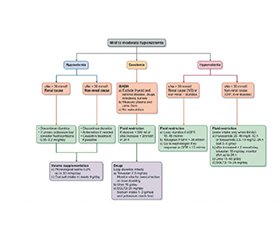
У випадках легкої та помірної гіпонатріємії з симптомами слід робити повільну інфузію 3% NaCl після розрахунку дефіциту Na та часто контролювати рівень Na [9]. Однак хронічна гіпонатріємія від легкого до помірного ступеня зазвичай перебігає безсимптомно, оскільки центральна нервова система поступово адаптується до осмотичних змін. Отже, оцінка об’ємного статусу й етіологічна оцінка гіпонатріємії можуть бути вирішальними для призначення відповідних терапевтичних заходів (рис. 2). Крім того, існує різноманітність фармакологічних варіантів для кожного конкретного типу гіпонатріємії (табл. 1), незважаючи на обмежені докази жорстких рекомендацій щодо їх практичного використання.
/10.jpg)
Загалом безсимптомна гіпонатріємія легкого та середнього ступеня тяжкості потребує менш агресивного лікування. При гіповолемії слід ввести ізотонічну рідину NaCl без діуретиків, а при еуволемії слід обмежити добову кількість рідини до 1 л. При гіперволемії основну причину слід усувати шляхом обмеження споживання солі й рідини та регулярного застосування діуретиків.
Найчастіше гіповолемічна гіпонатріємія легкого та помірного ступеня може розглядатися як наслідок компенсаторної реакції АДГ на втрату електролітів і вільної води через шлунково-кишковий тракт (діарея або блювання), нирки (високі дози діуретиків, тубулопатії, первинні надниркова недостатність або гіпоальдостеронізм) [29] або кровотечу. Отже, етіологічне лікування разом із заміщенням об’єму є важливим.
Парентеральне введення фізіологічного розчину (NaCl 0,9%) у дозі 23–30 мл/кг/добу [30] вважається достатнім для корекції Na, але безпечним з точки зору можливої надмірної корекції. У випадках стабільного стану пацієнтів із можливим пероральним прийомом рідини рекомендовано щоденний прийом 9 г NaCl (еквівалент 1 л NaCl 0,9%) у кількох менших порціях рідини та прийомах їжі. Незалежно від способу введення необхідний початковий моніторинг Na через 6–8 годин і через 24 години, щоб уникнути надмірної корекції з відповідною адаптацією лікування.
Здебільшого легка або помірна гіперволемічна гіпонатріємія може виникнути у пацієнтів із ХСН [31] або печінковою недостатністю [32] і нефротичним синдромом. Збільшення позаклітинної рідини та низький внутрішньосудинний об’єм кровообігу є спільною характеристикою для всіх трьох станів. Диференційна діагностика гіпонатріємії, зумовлена будь-якою іншою причиною, і постійна оцінка об’єму крові є вирішальними для відповідного лікування.
FR має бути першим вибором для лікування ХСН і печінкової недостатності з рекомендацією щодо споживання води лише у разі спраги та моніторингу діурезу.
Петльові діуретики обмежують канальцеву проникність для відтоку електролітів і знижують осмоляльність мозкової речовини з подальшою стимуляцією АДГ. Вони найбільш ефективні для лікування гіпер- та еуволемічної гіпонатріємії. Дози фуросеміду коливаються від 20 до 40 мг кожні 8–12 годин, особливо ефективні при щоденному споживанні солі 3–5 г і у випадках підвищеної осмолярності сечі (uOsm) > 350 mOsm/kg [33].
У дослідженні EVEREST (NCT00674323) толваптан був показаний як безпечний і ефективний препарат із підвищенням Na на 5–6 ммоль/л за 7 днів при гіперволемічній гіпонатріємії, спричиненій ХСН [34]. Важливо, що початкова доза 15 мг призводить до повільного та безперервного підвищення sNa без ризику надмірної корекції, отже, моніторинг рівня Na не потрібен, якщо немає одночасного застосування петльових діуретиків. Толваптан може викликати можливий несприятливий ефект гіпертрансаміназемії, тому його не слід застосовувати при печінковій недостатності, якщо це не необхідно перед безпосередньою передопераційною підготовкою до трансплантації [35].
Лікування альбуміном не є виправданим, за винятком прогресуючих захворювань печінки з гіпоальбумінемією та низьким об’ємом кровообігу [34], щоб підвищити онкотичний тиск і позаклітинний об’єм, що, у свою чергу, зменшує стимуляцію АДГ. У зв’язку з цим рівні повинні підтримуватися якомога ближче до нижньої межі норми.
Незважаючи на відсутність твердих доказів, вважається, що сечовина в дозі 15–60 г/день збільшує осмотичний ефект на проксимальний каналець і у такий спосіб кількість діурезу, головним чином у пацієнтів із ХСН [36]. Крім того, здається, що це дуже ефективне й безпечне лікування для запобігання ускладенням, можливо пов’язаним із захворюваністю та смертністю [37].
Осмотичний діурез, посилений інгібіторами натрій-глюкозного котранспортера 2, також може бути корисним як останній варіант лікування у пацієнтів із серцевою недостатністю, але це не є рекомендацією, що ґрунтувалася б на доказах.
Еуволемічна гіпонатріємія від легкого до помірного ступеня є найпоширенішим типом гіпонатріємії у госпіталізованих пацієнтів, а також в амбулаторних пацієнтів. Найчастішою причиною є SIADH. Таким чином, інші ймовірні етіологічні причини (гіпотиреоз, гіперкортицизм, підвищений рівень АДГ, використання специфічних ліків, паранеопластичні процеси тощо) необхідно виключити (або провести лікування) перед початком терапії SIADH. Вибір варіанту лікування має ґрунтуватися на клінічній оцінці й аналізі ризику та користі, оскільки не існує «найкращої» терапії, яка б підходила всім пацієнтам із SIADH [38].
При FR виведення води з організму має перевищувати добову норму споживання води (в/в або перорально). Незважаючи на те, що європейські [9] й американські рекомендації [10] подають його як засіб першої лінії для лікування гіпонатріємії, ефективність FR сумнівна [39]. Однак, як засвідчує одне РКД, на сьогодні лише дві третини пацієнтів із SIADH на FR порівняно з пацієнтами, які не отримували лікування, досягли цільового Na > 130 ммоль/л після 3 днів лікування [40]. Стандартна рекомендація пити лише під час спраги або прийому їжі може певною мірою бути ефективною. Тобто, якщо суворо її дотримуватися, як було показано в ретроспективному дослідженні 34 пацієнтів з SIADH із хронічною легкою гіпонатріємією, то таке обмеження може бути ефективним для нормалізації sNa у 76,5 % випадків [41]. Утім, корекція Na відбувається з дуже повільною швидкістю 1–2 мекв/л кожні 24–48 годин лише протягом кількох днів [40]. Крім того, FR може бути більш ефективним у випадках збереженої ниркової функції (діурез > 1500 мл/добу та мОсм > 500 мОсм/кг),
яка зазвичай знижена у літніх людей [42]. FR не рекомендується пацієнтам із недостатнім харчуванням та тим, хто не дотримується режиму лікування, з потребою у внутрішньовенному введенні рідини > 1 л/день, особливо у кліматичних умовах із високими температурами.
Петльові діуретики є ефективними при лікуванні еуволемічної гіпонатріємії, особливо коли uOsm > 350 mOsm/kg [33], хоча доказів недостатньо. Проте в нещодавньому РКД у 92 пацієнтів із SIADH комбінація фуросеміду, NaCl і FR не була кращою у корекції sNa порівняно з лише FR [43]. Крім того, у групі фуросеміду зросла частота гострого ураження нирок і гіпокаліємії.
На сьогодні ваптани, хоча вони й відносно дорогі, є препаратами з найкращими доказами нормалізації Na майже за 48 годин [32]. Однак американські та європейські рекомендації не дійшли однакового висновку щодо використання цього препарату [44]. На додаток до загального використання у пацієнтів із SIADH [25], рекомендації США, на відміну від європейських рекомендацій, радять їх використовувати пацієнтам із цирозом печінки або серцевою недостатністю, які не обмежують споживання рідини [45]. Нечисленні дані свідчать про те, що ваптани можуть бути дещо ефективнішими, ніж FR окремо при гіпер- або еуволемічній гіпонатріємії, але їх не слід застосовувати людям з гіповолемією [46]. Ваптан слід застосовувати з обережністю, кваліфікованими фахівцями з гіпонатріємії, за наявності відповідних лікарняних умов і можливості негайної реакції у випадках надмірної корекції. Початкова доза ваптану становить 7,5 мг, і її слід ретельно контролювати, якщо Na підвищується > 5 ммоль/л за 6 год. Дозу можна подвоїти, якщо корекція sNa становить ≤ 8 ммоль/л за 24 години, з таким же повторенням через 48 годин. Однак у конкретних пацієнтів із гіпокаліємією, алкоголізмом, недостатнім харчуванням, захворюваннями печінки [47] та високим ризиком ОРС корекцію Na слід обмежити до 8 ммоль/л, у пацієнтів із середнім ризиком — до 10 ммоль/л і до 12 ммоль/л за 24 год в інших. sNa слід вимірювати кожні 4–6 годин, і якщо підвищення досягло 8 ммоль/л протягом перших 12 годин, необхідно вжити заходів для запобігання подальшому підвищенню, порівнявши діурез із 5% розчином декстрози у воді. Надмірну корекцію слід компенсувати за протоколом «гальмування» з введенням десмопресину 2 мкг підшкірно, якщо є підвищення Na до 5 ммоль/л протягом перших 2 годин. Якщо ж між 6 і 8 ммоль/л, слід ввести додаткову внутрішньовенну 5% глюкозу зі швидкістю 2–3 мл/кг/год протягом 2–3 годин. Якщо сталася ненавмисна надмірна корекція, є можливість знову знизити рівні sNa за допомогою десмопресину для запобігання ураженням мозку [48].
Немає чітких доказів використання сечовини як єдиного або комбінованого лікування з ваптанами. Аналіз кількох серій випадків показав меншу частоту надмірної корекції та відсутність випадків ODS, пов’язаних із лікуванням сечовиною [49, 50]. Початкова доза становить 15 г, і якщо Na буде скориговано вище від ліміту, дозу наступного дня можна не приймати. І навпаки, якщо корекція Na на третій день недостатня, дозу слід подвоїти.
Інгібітор SGLT2 емпагліфлозин є ефективним лікуванням у дозі 25 мг/добу порівняно з плацебо [51], із середнім підвищенням Na 10 ммоль/л, хоча рандомізовані дослідження ще очікуються. Лікування інгібітором SGLT2 ефективніше за умови прийому 1–2 г солі за один прийом їжі або гіпертонічного (20%) NaCl у 500 мл фізіологічного розчину. Крім того, їжа, багата на калій, або внутрішньовенна інфузія хлориду калію можуть бути корисними для паралельного підвищення Na.
Нові розробки
Незважаючи на те, що це дуже частий і складний стан, існує не так багато препаратів, які розробляються для лікування гіпонатріємії, окрім уже розробленої групи ваптанів і кількох випробувань інгібіторів SGLT2. Замість цього існує потреба в різних визначеннях і підтвердженнях даних попередніх спостережень та серій випадків і запитань, які були поставлені з попереднього досвіду.
Сьогодні сечовина і толваптан вважаються найбільш ефективними препаратами другої лінії при SIADH. Таким чином, майбутні дослідження повинні бути спрямовані на проведення РКД FR із сечовиною або без неї, FR проти толваптану та порівняння можливого другого варіанта терапії після FR (сечовина, толваптан або інгібітори SGLT2). Оскільки всі три препарати потенційно можуть нести ризик надмірної корекції натрію (толваптан, звичайно, найвищий), виправдані прямі порівняльні випробування. Щоб забезпечити оптимальний результат для пацієнта, ретельний моніторинг і готовність до введення гіпотонічної рідини або десмопресину можуть бути вирішальними у процесі прийняття рішення щодо конкретного лікування та можливих наслідків надмірної корекції [52].
Відповідно до обох настанов (європейських і США), у випадках неефективності лікування першої лінії FR сечовина рекомендована як ефективний варіант другої лінії, хоча й без доказів РКД [9, 10]. Сечовина в декілька разів ефективніша порівняно з добавками NaCl, тобто 15-грамовий пакетик сечовини для перорального прийому забезпечує 250 мОсм ниркового навантаження розчиненими речовинами, тоді як 1-грамова таблетка NaCl забезпечує 34 мОсм. Однак погана переносимість сечовини обмежує її широке використання, оскільки гіркий смак можна лише трохи поліпшити ад’ювантами, як-от апельсиновий сік або лимонна кислота [9, 10]. Отже, є нові безпечні й ефективні пероральні препарати, що поліпшують його смак [53]. Доза пероральної сечовини становить 0,25–0,5 г/кг/добу (15–30 г/добу), і її слід збільшити у випадках вищої осмоляльності сечі, зазвичай > 30 г/добу [54]. Лікарі також знають, що у пацієнта може спостерігатися тимчасове підвищення концентрації сечовини в сироватці крові, але це не слід вважати погіршенням функції нирок [53]. Зрештою, це найдешевший препарат (< 3 доларів США за 30-грамову дозу) [54].
Дані щодо прямого порівняння між ваптанами та сечовиною відсутні. У невеликому дослідженні 12 пацієнтів із хронічним SIADH (середній sNa 125 ммоль/л) послідовно отримували ваптан (толваптан або сатаваптан), потім — сечовину 15–30 г/добу з перервою між курсами лікування. Відповідь була хорошою для обох препаратів (середній sNa збільшився до 135 ммоль/л), а переносимість була подібною [55]. Невеликий розмір вибірки дослідження був величезним обмеженням, але він дав напрямок для майбутніх наукових пошуків. Сьогодні сечовина може бути переважною терапією другої лінії з огляду на невеликий ризик надмірної корекції, слабкості, необхідності тривалого лікування пацієнтів із SIADH та запобігання повторній госпіталізації, особливо зважаючи на обмеження часу застосування толваптану (30 днів) або протипоказання в пацієнтів з порушенням функції печінки. Нарешті, ризик надмірної корекції з попереднього клінічного досвіду й індивідуальних даних кожного препарату окремо свідчить про потенційно менший ризик лікування сечовиною.
На питання про використання толваптану як терапії другої лінії в основному госпіталізованих пацієнтів із SIADH, рефрактерним до FR, має відповісти поточний протокол РКД для стаціонарних пацієнтів (ACTRN12619001683123), який, сподіваємося, надасть докази для рекомендації щодо лікування толваптаном [56]. Крім того, він повинен запропонувати відповідь щодо використання толваптану як початкової терапії та його ефективності й безпеки порівняно зі стандартною FR у лікарняних пацієнтів із помірною та тяжкою гіпонатріємією [56]. Утім, залишається той факт, що висока вартість ваптанів порівняно з аналогічною реакцією від дуже дешевої обробки сечовиною [55] спонукатиме майбутні РКД до цього дуже важливого порівняння.
За останні пару років зріс інтерес до лікування гіпонатріємії інгібіторами SGLT2, які стимулюють осмотичний діурез протягом підвищеної глюкозурії. У рамках нещодавнього РКД вивчався стан 87 пацієнтів, госпіталізованих з приводу гіпонатріємії SIADH, які отримували емпагліфозин у дозі 25 мг/добу на додаток до стандартної FR. Через 4 дні у пацієнтів, які отримували емпагліфлозин, спостерігалося значно більше підвищення Na порівняно з пацієнтами, які отримували плацебо (10 проти 7 ммоль/л). Сприятливими факторами були глибока гіпонатріємія (< 125 ммоль/л) і нижча осмоляльність на початковому рівні [51]. Однак це ще не було достатнім доказом, щоб рекомендувати інгібітор SGLT2 як специфічне лікування SIADH. Таким чином, та сама група авторів виконала інше 4-тижневе РКД із перехресним дизайном з емпагліфлозином 25 мг/добу порівняно з плацебо в амбулаторних пацієнтів із хронічною гіпонатріємією внаслідок SIADH. Медіана sNa підвищилася під час дослідження зі 131 до 134 ммоль/л у групі лікування, тоді як підвищення не спостерігалося у групі плацебо [57]. Слід зазначити, що серйозних побічних ефектів не було і препарат добре переносився, хоча група була невеликою (14 пацієнтів). Сподіваємося, поточне дослідження лікування емпагліфлозином у стаціонарних і амбулаторних пацієнтів з гіперволемією й еуволемією від легкої до помірної гіпонатріємії має підтвердити цей багатообіцяючий ефект [58].
Відповідь на питання про те, чи призводить корекція гіпонатріємії у госпіталізованих пацієнтів до зниження ризику смерті та тривалості перебування або повторної госпіталізації, є важливим аспектом лікування гіпонатріємії [59, 60]. У дослідженні за участю 18 пацієнтів з гіпонатріємією (≤ 127 ммоль/л), які проходили спеціалізоване лікування, порівняно з 23 контрольними пацієнтами (середній sNa 124,1 ммоль/л) було показано, що спостерігалося набагато швидше підвищення Na (≥ 5 ммоль/л) і коротше перебування в лікарні у групі втручання [59]. Крім того, інше одноцентрове ретроспективне дослідження протягом 5-річного періоду показало, що гіпонатріємія (< 120 ммоль/л), яку лікує спеціаліст, може знизити ризик смертності у 91 % пацієнтів [60]. Чи зменшує корекція гіпонатріємії у госпіталізованих пацієнтів ризик смерті або повторної госпіталізації [61], у поточному багатоцентровому міжнародному РКД, що набирається, ще належить підтвердити.
Що стосується прогнозу, то він залежить від тяжкості й основної причини гіпонатріємії та є поганим при гострій, тяжкій гіпонатріємії, особливо у літніх людей [62]. Наслідками нелікованої або неадекватно лікованої гіпонатріємії є підвищення захворюваності та смертності, збільшення тривалості перебування в лікарні й фінансовий тягар для суспільства [63]. Швидка корекція хронічної гіпонатріємії може спричинити ODS, і її слід лікувати десмопресином [64] у дозі 2–4 мкг парентерально кожні 6–8 годин відповідно до рівня Na.
Висновки
Гіпонатріємія є найпоширенішим електролітним розладом у лікарняних пацієнтів і пов’язана з коротко- й довгостроковою захворюваністю та смертністю. Швидкість корекції за допомогою 3% NaCl у вигляді 100-мл внутрішньовенного болюсу або безперервної інфузії залежить від тяжкості та стійкості симптомів і потребує частого біохімічного моніторингу. Швидке періодичне введення гіпертонічного розчину є кращим для лікування симптоматичної гіпонатріємії.
Майже половина пацієнтів із SIADH не реагують на FR як терапію першої лінії. На сьогодні сечовина і толваптан вважаються найефективнішими препаратами другої лінії при SIADH. Однак доказів для вказівок щодо вибору терапії другої лінії гіпотонічної гіпонатріємії бракує, окрім кількох РКД толваптану й емпагліфлозину, які порівнюють препарати з плацебо. Пероральна сечовина вважається дуже ефективним і безпечним засобом лікування. Легку та безсимптомну гіпонатріємію лікують достатнім споживанням розчинених речовин (солі та білка) і початковим FR з коригуванням на основі рівня sNa. Специфічне лікування ваптанами може розглядатися у пацієнтів з еуволемією або гіперволемією з високою активністю АДГ.
Щоб забезпечити оптимальні результати для пацієнтів, ретельний моніторинг і готовність до введення гіпотонічної рідини або десмопресину можна вважати вирішальними для специфічного лікування та можливої надмірної корекції [52]. Незважаючи на поліпшення обізнаності щодо гіпонатріємії, пов’язаної з лікарнею (введення гіпоосмотичної рідини) та ризику ODS (надмірна терапевтична корекція), необхідний ретельний моніторинг, щоб уникнути ятрогенної захворюваності. Поступова корекція та клінічна оцінка відповідно до настанов є кращими порівняно зі швидкою нормалізацією sNa до лабораторного референсного діапазону [65].

/9.jpg)
/10.jpg)
/11.jpg)